Las enfermedades de almacenamiento de lípidos o lipidosis, son un grupo de trastornos metabólicos hereditarios en los cuales cantidades nocivas de material graso (lípidos) se acumulan en varias células y tejidos en el cuerpo.
Las personas con estos trastornos o no producen suficiente cantidad de una de las enzimas necesarias para romper (metabolizar) los lípidos o producen enzimas que no funcionan adecuadamente.
Con el tiempo, este almacenamiento excesivo de grasas puede ocasionar daño celular y tisular permanente, particularmente en el cerebro, el sistema nervioso periférico (los nervios que van de la médula espinal al resto del cuerpo), el hígado, el bazo y la médula ósea.
Hipercolesterolemia Familiar
El hipercolesterolemia familiar es un trastorno genético causado por un defecto en el cromosoma 19.
El defecto hace que el cuerpo sea incapaz de eliminar la lipoproteína de baja densidad (colesterol LDL o malo) de la sangre. Esto provoca un nivel alto de colesterol LDL en la sangre. Esto lo hace más propenso a presentar estrechamiento de las arterias a raíz de ateroesclerosis a temprana edad. La afección se hereda típicamente de forma autosómica dominante.
Sintomas:
-
Piel: depósitos de colesterol en las manos, los codos y las rodillas. También pueden aparecer en la piel que rodea los ojos.
-
Tendones: Los depósitos de colesterol pueden engrosar el tendón de Aquiles, junto con algunos tendones de las manos.
-
Ojos: Los niveles elevados de colesterol pueden provocar un arco corneal, un anillo blanco o gris alrededor del iris del ojo.
Diagnóstico:
-
Prueba Sanguínea
-
Prueba Genética
-
ECG
Enfermedad de Gaucher
La enfermedad de Gaucher es una enfermedad hereditaria poco frecuente en donde una persona no tiene una cantidad suficiente de una enzima llamada glucocerebrosidasa. Esto causa una acumulación de sustancias grasosas en el bazo, hígado, pulmones, huesos y a veces, en el cerebro.
La enfermedad de Gaucher tiene tres subtipos clínicos frecuentes:
-
Tipo 1: Esta es la forma más común y causa un agrandamiento del hígado y el bazo, dolor y fracturas (huesos rotos) y, a veces, problemas en los pulmones y riñones. No afecta al cerebro. Puede ocurrir a cualquier edad
-
Tipo 2: Este tipo causa daño cerebral grave y aparece en recién nacidos. La mayoría de los niños fallece antes de los dos años
-
Tipo 3: En este tipo puede haber agrandamiento del hígado y bazo. El cerebro se ve afectado poco a poco. En general, comienza en la niñez o adolescencia.
Síntomas:
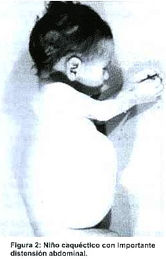
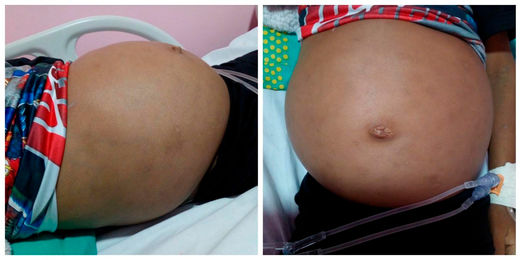
Pueden incluir daño cerebral, aumento de volumen del bazo y el hígado, disfunción hepática, trastornos esqueléticos y lesiones óseas que pueden producir dolor y fracturas, inflamación de los ganglios linfáticos y (ocasionalmente) de las articulaciones adyacentes, distensión abdominal, tinte castaño en la piel, anemia, plaquetas bajas y manchas amarillas en los ojos. Las personas afectadas de manera más grave también pueden ser más susceptibles a las infecciones. La enfermedad afecta tanto a hombres como a mujeres por igual.
Diagnóstico:
Durante una exploración física, el médico presionará el abdomen del paciente para comprobar el tamaño del bazo y del hígado. Para determinar si tiene la enfermedad de Gaucher, el médico comparará la estatura y el peso con los gráficos de crecimiento estandarizados. También podría recomendar determinados análisis de laboratorio, exploraciones por imágenes y asesoramiento en genética.
Análisis de laboratorio
Pueden analizarse las muestras de sangre para detectar los niveles de la enzima asociada con la enfermedad de Gaucher. Un análisis genético puede revelar si tienes la enfermedad.
Pruebas de diagnóstico por imágenes
Las personas a las que se les diagnostica la enfermedad de Gaucher, por lo general, requieren pruebas periódicas para controlar su avance, que comprenden las siguientes:
-
Absorciometría de rayos X de energía dual. Esta prueba utiliza rayos X de bajo nivel para medir la densidad ósea.
-
Resonancia magnética (RM). Con el uso de ondas de radio y un fuerte campo magnético, una resonancia magnética puede mostrar si el bazo o el hígado están agrandados, y si la médula ósea ha sido afectada.
Tratamiento:
Si bien no hay una cura para la enfermedad de Gaucher, existen diversos tratamientos que pueden ayudar a controlar los síntomas, prevenir el daño irreversible y mejorar la calidad de vida. Algunas personas tienen síntomas tan leves que no necesitan tratamiento. Es probable que el médico recomiende un control de rutina para supervisar la progresión y las complicaciones de la enfermedad. La frecuencia con la que necesites controles dependerá de la situación.
Enfermedad de Niemann-Pick
La enfermedad de Niemann-Pick es un grupo de trastornos autosómicos recesivos ocasionados por la acumulación de grasa y colesterol en las células del hígado, del bazo, de la médula ósea, de los pulmones y, en algunos casos, del cerebro.
La enfermedad de Niemann-Pick se subdivide en tres categorías:
-
Tipos A y B:
Los tipos A y B se producen por la falta o mal funcionamiento de una enzima llamada «esfingomielinasa». Esto afecta la capacidad del cuerpo para metabolizar las grasas, lo que provoca una acumulación de grasa en las células. Esto ocasiona la disfunción de las células y, en última instancia, su muerte. El tipo A se produce principalmente en los bebés, que presentan enfermedades cerebrales graves y progresivas. No existe ninguna cura, por lo que la mayoría de los niños no sobreviven a los primeros años de vida. El tipo B suele producirse más adelante durante la niñez y no está asociado con enfermedades cerebrales graves. La mayoría de las personas afectadas por el tipo B sobreviven y llegan a la edad adulta.
-
Tipo C:
El tipo C de la enfermedad de Niemann-Pick es hereditario y poco frecuente. Las mutaciones genéticas de este tipo hacen que se acumule colesterol y otras grasas en el hígado, el bazo o los pulmones. Finalmente, el cerebro también se ve afectado.
Algunos signos y síntomas de la enfermedad de Niemann-Pick pueden ser:
-
Torpeza y dificultad para caminar.
-
Contracciones musculares excesivas (distonía) o movimiento de los ojos.
-
Alteraciones del sueño.
-
Dificultad para tragar y comer.
-
Neumonía recurrente.
Diagnóstico:
El diagnóstico de la enfermedad de Niemann-Pick comienza con una exploración física exhaustiva, la cual puede indicar un signo de advertencia temprana, como un agrandamiento del hígado o bazo. El médico realizará una historia clínica detallada y analizará tanto los síntomas como los antecedentes médicos de tu familia. La enfermedad de Niemann-Pick es poco frecuente y sus síntomas pueden confundirse con los de otras enfermedades. Las técnicas de diagnóstico utilizadas dependen del tipo de enfermedad de Niemann-Pick.
Tipo A o B. Usando una muestra de sangre o piel (biopsia), los expertos miden qué nivel de esfingomielinasa se encuentra en los glóbulos blancos para confirmar el diagnóstico.
Tipo C. Los expertos toman una pequeña muestra de piel para detectar la enfermedad de Niemann-Pick y evaluar cómo las células se mueven y almacenan colesterol.
También se pueden realizar otras pruebas, como las siguientes:
-
Resonancia magnética (RM).
-
Examen ocular.
-
Análisis genéticos.
-
Análisis prenatales.
Tratamiento:
La enfermedad de Niemann-Pick no tiene cura. No existen tratamientos efectivos para las personas con el tipo A o B. Una opción para las personas que tienen el tipo C (leve a moderado), puede ser el fármaco conocido como «miglustat» (Zavesca). Un estudio internacional de 92 personas con Niemann-Pick tipo C reveló una mejoría en los síntomas neurológicos después de haber tomado miglustat en forma regular durante un promedio de dos años. La fisioterapia es una parte importante del tratamiento para conservar la movilidad tanto como sea posible. Las personas con la enfermedad de Niemann-Pick deben hacer consultas regulares con el médico porque la enfermedad progresa y los síntomas empeoran.
Enfermedad de Fabry
La enfermedad de Fabry es un tipo de enfermedad de depósito lisosomal llamada esfingolipidosis. Está causada por un depósito de glucolípidos en los tejidos. Esta enfermedad provoca excrecencias cutáneas, dolor en las extremidades, vista deficiente, episodios repetitivos de fiebre, insuficiencia renal y enfermedad cardíaca.
La enfermedad de Fabry ocurre cuando los padres transmiten a sus hijos un gen defectuoso que causa esta enfermedad.
La esfingolipidosis ocurre cuando las personas no tienen las enzimas necesarias para descomponer (metabolizar) los esfingolípidos. En la enfermedad de Fabry, los glucolípidos, un producto del metabolismo de los lípidos, se acumulan en los tejidos. La enzima necesaria para descomponer el glucolípido, llamada alfa-galactosidasa A, no funciona correctamente. Dado que el gen defectuoso de este trastorno poco frecuente se transmite por el cromosoma X, la fase avanzada de la enfermedad se produce solo en los varones. Debido a que las niñas tienen dos cromosomas X, las niñas afectadas pueden tener síntomas, pero no desarrollan la enfermedad de Fabry en toda regla.
Síntomas:
Crecimientos cutáneos.
Problemas oculares.
Insuficiencia renal.
Enfermedad cardíaca.
Antes del nacimiento, la enfermedad de Fabry se puede diagnosticar en el feto mediante las pruebas de cribado prenatales, biopsia de vellosidades coriónicas o amniocentesis.
Tratamiento:
Terapia de sustitución enzimática.
Algunas veces, trasplante de riñón.
Los médicos tratan la enfermedad de Fabry con terapia de sustitución enzimática (agalsidasa beta). El tratamiento también consiste en la toma de analgésicos para ayudar a aliviar el dolor y la fiebre o anticonvulsivos. Las personas con insuficiencia renal pueden necesitar un trasplante de riñón.
Diagnóstico:
Pruebas de cribado prenatal.
Pruebas de cribado del recién nacido
Otros análisis de sangre
Enfermedad de Farber
La enfermedad de Farber, también conocida como lipogranulomatosis de Farber, describe un grupo de trastornos autosómicos recesivos poco frecuentes que causan acumulación de material graso en las articulaciones, los tejidos y el sistema nervioso central. Afecta tanto a hombres como a mujeres.
Síntomas:
-
Síntomas neurológicos en las primeras semanas de vida.
-
Aumento del estado de letargia somnolencia.
-
Problemas para tragar.
-
Contracturas articulares.
-
Vómitos.
-
Artritis.
-
Ganglios linfáticos inflamados.
-
Articulaciones inflamadas.
-
Ronquera.
-
Nódulos debajo de la piel que se engrosan alrededor de las articulaciones a medida que avanza la enfermedad.
Diagnóstico:
El diagnóstico está basado en los hallazgos clínicos y de laboratorio relativos a la actividad de la ceramidasa ácida en leucocitos de sangre periférica o en cultivos de células linfoides o de fibroblastos de piel. Alternativamente, el diagnóstico puede realizarse por determinación de la concentración de ceramida en cultivos celulares o tisulares o mediante el estudio del catabolismo de las ceramidas lisosomales en células vivas en cultivo. Por lo general, la identificación de mutaciones en el gen ASAH1 mediante análisis genético molecular permite confirmar el diagnóstico.
Tratamiento:
Actualmente no existe un tratamiento específico para la enfermedad de Farber. Los corticosteroides pueden ayudar a aliviar el dolor. Los trasplantes de médula ósea pueden mejorar los granulomas (pequeñas masas de tejido inflamado) en las personas con poca o ninguna complicación en los pulmones o el sistema nervioso. Las personas mayores pueden tener sus granulomas reducidos o extirpados quirúrgicamente
Gangliosidosis
Las gangliosidosis se componen de dos grupos distintos de enfermedades genéticas. Ambos son autosómicos recesivos y afectan tanto a hombres como a mujeres por igual.
Gangliosidosis GM1
Las gangliosidosis GM1 se producen por deficiencia de la enzima beta-galactosidasa, lo que ocasiona almacenamiento anormal de materiales lipídicos ácidos en particular en las células nerviosas de los sistemas nerviosos central y periférico. La gangliosidosis GM1 tiene tres presentaciones clínicas:
-
La GM1 infantil temprana (el subtipo más grave, con inicio poco después del nacimiento).
-
La gangliosidosis GM1 infantil tardía, normalmente, comienza entre 1 y 3 años de edad.
-
La gangliosidosis GM1 adulta se desarrolla entre los 3 y 30 años de edad.
Gangliosidosis GM2
Las gangliosidosis GM2 también hacen que el cuerpo almacene exceso de material graso ácido en tejidos y células, más notablemente en las células nerviosas.
Síntomas y signos:
Los signos clínicos son variables e incluyen detención/regresión del desarrollo neurológico, hipotonía, visceromegalia, manchas maculares rojo cereza, disostosis y rasgos de engrosamiento facial. Pueden producirse miocardiopatías.
Diagnóstico:
Su diagnóstico está basado en signos clínicos, aunque los signos clásicos no siempre están presentes en el diagnóstico. Los test bioquímicos y/o genéticos confirman el diagnóstico.
-
Diagnóstico diferencial. El diagnóstico diferencial incluye mucopolisacaridosis, esfingolipidosis y oligosacaridosis
-
Diagnóstico prenatal. El diagnóstico prenatal puede realizarse mediante un análisis de la actividad de la beta-galactosidasa y/o mediante un análisis molecular de GLB1 en las células de las vellosidades coriónicas (VC) o del líquido amniótico, si las mutaciones han sido identificadas en un caso índice.
Tratamiento:
El tratamiento para pacientes con gangliosidosis GM1 es sintomático y de soporte. La terapia de reducción de sustrato es un posible enfoque para los ensayos clínicos en las formas de aparición tardía.
Enfermedad de Krabbé
La enfermedad de Krabbé (también conocida como leucodistrofia de células globoides y lipidosis galactosilceramida) es un trastorno autosómico recesivo que se produce por deficiencia de la enzima galactocerebrosidasa.
Un defecto en el gen GALC causa la enfermedad de Krabbe. La gente con este defecto genético no produce suficiente cantidad de una sustancia (enzima) llamada galactocerebrósido beta-galactosidasa (galactosilceramidasa). El cuerpo necesita esta enzima para producir la mielina. Esta rodea y protege las fibras nerviosas. Sin esta enzima, la mielina se descompone, las neuronas mueren y los nervios en el cerebro y otras zonas del cuerpo no trabajan adecuadamente.
La enfermedad de Krabbé puede desarrollarse en diversas etapas:
-
La enfermedad de Krabbé de aparición temprana se presenta en los primeros meses de vida. La mayoría de los niños con esta forma de la enfermedad muere antes de cumplir los 2 años de edad.
-
La enfermedad de Krabbé de aparición tardía empieza a finales de la niñez o a comienzos de la adolescencia.
Síntomas:
Los síntomas de la enfermedad de Krabbé de aparición temprana son:
-
Cambios en el tono muscular de flácido a rígido.
-
Pérdida de la audición que lleva a sordera.
-
Retraso del desarrollo.
-
Dificultades en la alimentación.
-
Irritabilidad y sensibilidad a los ruidos altos.
-
Convulsiones graves (pueden comenzar a edad muy temprana).
-
Fiebres inexplicables.
-
Pérdida de la visión que lleva a ceguera.
-
Vómitos.
Con la enfermedad de Krabbe de aparición tardía, los problemas de visión pueden aparecer primero, seguidos de dificultades para caminar y músculos rígidos. Los síntomas varían de una persona a otra. También se pueden presentar otros síntomas.
Pruebas y exámenes:
El proveedor de atención médica llevará a cabo un examen físico y preguntará acerca de los síntomas. Los exámenes que se pueden hacer incluyen:
-
Examen de sangre para buscar niveles de galactosilceramidasa en los glóbulos blancos.
-
Proteína total en LCR: analiza la cantidad de proteína en el líquido cefalorraquídeo (LCR).
-
Pruebas genéticas para detectar la anomalía en el gen GALC.
-
Resonancia magnética de la cabeza.
-
Velocidad de conducción nerviosa.
Tratamiento:
No hay un tratamiento específico para la enfermedad de Krabbe. Algunas personas se han sometido a un trasplante de médula ósea en las etapas iniciales de la enfermedad, pero este tratamiento tiene riesgos.
Leucodistrofia metacromática
La leucodistrofia metacromática (MLD, por sus siglas en inglés) es un grupo de trastornos marcados por el almacenamiento de depósitos en la materia blanca del sistema nervioso central, en los nervios periféricos y, en cierta medida, en los riñones. Este trastorno autosómico recesivo es producido por una deficiencia de la enzima arilsulfatasa A. Afecta tanto a hombres como a mujeres.
La leucodistrofia metacromática tiene tres formas características: infantil tardía, juvenil y adulta.
-
La leucodistrofia metacromática infantil tardía, por lo general, comienza entre los 12 y los 20 meses de edad
-
La leucodistrofia metacromática juvenil normalmente comienza entre los 3 y 10 años de edad.
-
Los síntomas de la forma adulta comienzan después de los 16 años de edad
Síntomas:
Los síntomas de LDM puede incluir cualquiera de los siguientes:
-
Tono muscular anormalmente alto o bajo, movimientos musculares anormales, cualquiera de estos puede causar problemas para caminar y caídas frecuentes.
-
Problemas de comportamiento, cambios de personalidad, irritabilidad.
-
Disminución del funcionamiento intelectual.
-
Dificultad para tragar.
-
Incapacidad para realizar tareas normales.
-
Incontinencia.
-
Rendimiento escolar deficiente.
-
Convulsiones.
-
Dificultades del habla, mala pronunciación.
Pruebas y exámenes:
El proveedor de atención médica realizará un examen físico, enfocándose en los síntomas del sistema nervioso: Los exámenes que se pueden hacer incluyen:
-
Hemocultivo o cultivo de piel para buscar baja actividad de la arilsulfatasa A.
-
Examen de sangre para buscar niveles bajos de la enzima arilsulfatasa A.
-
Pruebas de ADN para el gen ARSA.
-
Resonancia magnética del cerebro.
-
Biopsia del nervio.
-
Estudios de velocidad de conducción del nervio.
-
Análisis de orina.
Tratamiento:
No existe una cura para la LDM. Los cuidados se centran en el tratamiento de los síntomas y en la preservación de la calidad de vida del paciente con fisioterapia y terapia ocupacional. Se puede considerar realizar un transplante de médula en casos de bebés con LDM.
En las investigaciones, se están estudiando maneras de reponer la enzima (arilsulfatasa A) faltante
Enfermedad de Wolman
La enfermedad de Wolman, también conocida como deficiencia de lipasa ácida, es un trastorno de almacenamiento de lípidos grave que es, por lo general, letal hacia el año de vida. Este trastorno autosómico recesivo está marcado por la acumulación de ésteres de colesterol (normalmente una forma de transporte del colesterol) y triglicéridos (una forma química en la cual existen las grasas en el cuerpo) que se pueden acumular de manera significativa y ocasionar daño en las células y los tejidos. Este trastorno afecta tanto a hombres como a mujeres.
Síntomas:
-
Deterioro mental progresivo.
-
Aumento de volumen del hígado.
-
Aumento de volumen del bazo.
-
Distensión abdominal.
-
Problemas gastrointestinales.
-
Ictericia.
-
Anemia.
-
Vómitos.
-
Depósitos de calcio en las glándulas suprarrenales lo que hace que se endurezcan.
Diagnóstico:
El diagnóstico se puede confirmar rápidamente midiendo la actividad enzimática en leucocitos o en muestras de sangre seca impregnada en papel de filtro, revelando una deficiencia casi total.
-
Diagnóstico diferencial
El diagnóstico diferencial incluye la histiocitosis hemofagocítica familiar y otros síndromes fagocíticos, la enfermedad de Gaucher tipo II, la enfermedad de Niemann Pick tipo A y neoplasias como la leucemia o el neuroblastoma.
-
Diagnóstico prenatal
El diagnóstico prenatal se puede realizar midiendo la actividad enzimática o mediante el análisis mutacional en muestras de vellosidades coriónicas o amniocitos.
Tratamiento:
No existe un tratamiento efectivo para la enfermedad de Wolman.
Enfermedad de almacenamiento de ésteres de colesterol
Otro tipo de deficiencia de lipasa ácida es la enfermedad de almacenamiento de ésteres de colesterol. Este trastorno extremadamente infrecuente es consecuencia del almacenamiento de ésteres de colesterol y triglicéridos en las células sanguíneas y en la linfa y el tejido linfático.
Síntomas:
Aumento de volumen del hígado que produce cirrosis e insuficiencia hepática crónica antes de la adultez. Los niños también pueden tener depósitos de calcio en las glándulas suprarrenales y desarrollar ictericia en etapas tardías del trastorno.
Diagnóstico:
El diagnóstico de la deficiencia de la lipasa acida se en individuos con hallazgos característicos como hepatomegalia, elevación de transaminasas y un perfil de lípidos típico mostrando niveles altos de colesterol, lipoproteínas de baja densidad y triglicéridos y niveles bajos de lipoproteína de alta densidad.
-
El diagnóstico se confirma con la prueba genética del gen LIPA o por examen que muestra la deficiencia de la actividad de la enzima lipasa ácida lisosómica (LAL) en los leucocitos de la sangre, en fibroblastos de la piel o en las manchas de sangre seca.
Tratamiento:
El reemplazo enzimático tanto para la enfermedad de Wolman como para la enfermedad de almacenamiento de ésteres de colesterol está actualmente bajo investigación activa.
Últimas noticias